多糖多酚复杂植物 RNA 快速提取试剂盒 ZS-M11020
Superbrilliant®多糖多酚/复杂植物 RNA 快速提取试剂盒
Superbrilliant®Polysaccharide polyphenols / complex plant
RNA rapid extraction kit
Cat.No.:ZS-M11020
Superbrilliant®Polysaccharide polyphenols / complex plant
RNA rapid extraction kit
Cat.No.:ZS-M11020
组分:
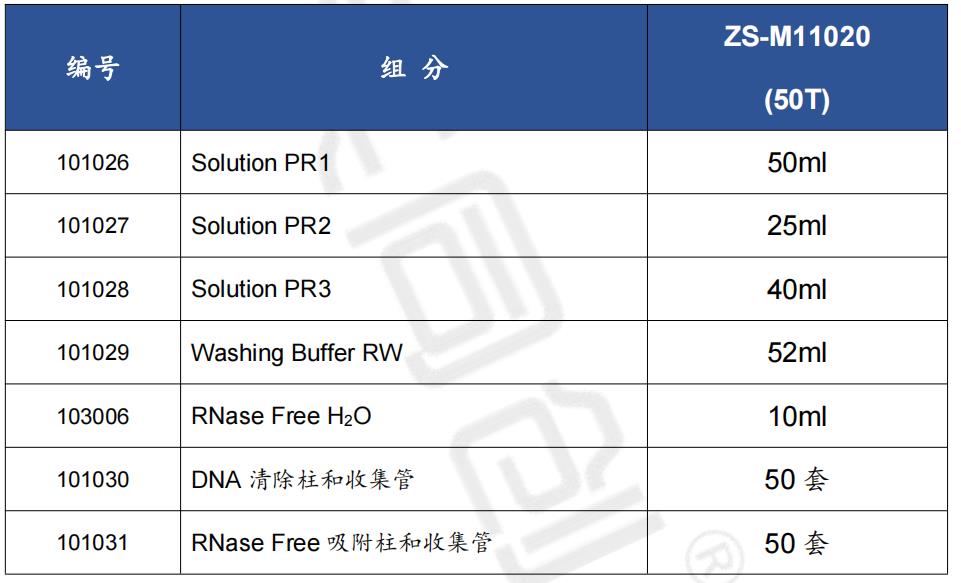
储存:
1.室温下(15℃-25℃)储存。
2.避免试剂长时间暴露于空气中,各溶液使用后应及时盖紧盖子。
简介:本公司在无苯酚、氯仿 RNA 快速提取技术基础上,又独家研发成功基因组 DNA 清除柱技术可以有效清除 gDNA 残留,得到的 RNA 不需要 DNase 消化,可用于反转录 PCR、荧光定量 PCR 等实验。本试剂盒可从植物组织,特别是富含多糖多酚的植物组织中快速提取总RNA,可同时处理大量不同样品。独特的裂解液迅速裂解细胞和灭活细胞 RNA 酶,离心沉淀去除多糖多酚和次级代谢产物,裂解混合物用乙醇调节 RNA 结合吸附到基因组 DNA 清除柱,RNA 被选择性洗脱过滤,吸附在基因组 DNA 清除柱上的 DNA 无法洗脱连同柱子一起丢弃去
除 DNA。RNA 用乙醇调节结合条件后,在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过快速的漂洗-离心的步骤,将细胞代谢物,蛋白等杂质去除。低盐的 RNase Free H2O可将 RNA 从硅基质膜上洗脱下来。
注意事项:
1.所有的离心步骤均可在室温完成,使用转速可以达到 13,000rpm 的传统台式离心机,如Eppendorf 5415C 或者类似离心机。
2.需要自备β-巯基乙醇,乙醇,研钵(可选)。
3.样品处理量不要超过 DNA 清除柱和 RNA 吸附柱的处理能力。开始摸索实验条件时,可使用较少的样品处理量,根据试验情况增加或者减少样品处理量。
4.Solution PR1 和 Solution PR2 和 Solution PR3 中含有刺激性化合物,操作时戴乳胶手套,避免沾染皮肤,眼睛和衣服。若沾染皮肤、眼睛时,要用大量清水或者生理盐水冲洗。
5.关于 DNA 的微量残留:一般说来任何总 RNA 提取试剂在提取过程中无法完全避免 DNA 的微量残留(DNase I 消化也无法做到 100%无残留),本公司的 RNA 提取产品,采取了本公司独特的缓冲体系和 DNA 清除柱技术,绝大多数 DNA 已经被清除,不需要 DNase I 消化,可直接用于反转录 PCR 和荧光定量 PCR。个别特殊情况如 DNA 含量过于丰富造成残留或者要进行严格的 mRNA 表达量分析荧光定量 PCR,我们建议在进行模板和引物的选择时:
a.选用跨内含子的引物,以穿过 mRNA 中的连接区,DNA 就不能作为模板参与扩增反应。
b.选择基因组 DNA 和 cDNA 上扩增的产物大小不一样的引物对。
c .将 RNA 提取物用 RNase Free 的 DNase I 处理。
d.在 Solution PR3 漂洗前,直接在 RNase Free 吸附柱上进行 DNase I 柱上消化处理。
操作步骤:(实验前请先阅读注意事项)
前期准备:取 1ml Solution PR1 于离心管内(如果 Solution PR1 有析出或者沉淀需先置于 65℃水浴直至溶液澄清),在 Solution PR1 中加入β-巯基乙醇(1ml Solution PR1 加 50μl β-巯基乙醇)。颠倒混匀后 65℃水浴中预热。多个样品则按照比例放大准备。
1.直接研磨法(实验室无液氮情况下或者柔软易研磨植物样品推荐此法):
a.新鲜植物组织或者冰冻保存样品称重后取 100mg-200mg(水分少的样品如叶片种子等可加 100mg-150mg,水分多的样品如草莓西瓜果实可多加一些)迅速剪成小块放入研钵,加入 1ml Solution PR1(已加有β-巯基乙醇)室温下充分研磨成匀浆,注意应该迅速研磨让组织和 Solution PR1 立刻充分接触以抑制 RNA 酶活性。(β-巯基乙醇是 Solution PR1 的关键成分,必要的时候可以提高终浓度到 10-20%。如果特别复杂植物,可以尝试在裂解液中加入 PVP40至终浓度为 2%。)
b.将裂解物转入离心管,立即剧烈振荡 15 秒,放回 65°C 水浴中 5-10min,期间颠倒 1-2次帮助裂解。13000rpm 离心 10 分钟。
c.取上清到一个新 1.5ml 离心管。加入上清体积一半的无水乙醇,此时可能出现沉淀,但是不影响实验,应立即吹打混匀。取上清时表面有漂浮物,用吸头挑开吸取下面清澈液体即可。
d.立刻进行操作步骤的步骤 3。
2.液氮研磨法(适用广泛,提取复杂难破碎,易降解样品时推荐此法):
a.液氮中研磨新鲜或-70°C 冷冻的材料至细粉。
b.转移 100mg-200mg 细粉(水分少的样品如叶片种子等可加 100mg-150mg,水分多的样品如草莓西瓜果实可多加一些)到 Solution PR1(已加有β-巯基乙醇)离心管中。立即剧烈涡旋 30-60 秒或者用吸头吹打混匀裂解,降低粘稠度和提高产量。
c.放回 65°C 水浴中(5-10min),中间偶尔颠倒 1-2 次帮助裂解。
d.将裂解物 13,000rpm 离心 10 分钟。
e.取上清转到一个新 1.5ml 离心管。加入上清体积一半的无水乙醇,此时可能出现沉淀,但是不影响提取过程,立即吹打混匀。取上清时表面有漂浮物,用吸头挑开吸取下面清澈液体即可。
f.立刻进行操作步骤的步骤 3。
3.将混合物(每次小于 720μl,可以多次加入)加入 DNA 清除柱中,清除柱放入收集管中,13,000rpm 离心 2 分钟,弃掉废液。确保离心后液体全部滤过去,膜上没有残留,如有必要,可以加大离心力和离心时间。
4.将基因组 DNA 清除柱子放在一个干净 2ml 离心管内(不需 RNase Free 或者 DEPC 处理,一般干净的新离心管即可。),在 DNA 清除柱内加 500μl Solution PR2,13,000rpm 离心 30秒,收集滤液(RNA 在滤液中),加入 0.5 倍体积的无水乙醇(通常为 450-500μl 左右),此时可能出现沉淀,但是不影响提取过程,立即吹打混匀。
5.立刻将混合物(每次小于 720μl,可以分多次加入)加入一个 RNase Free 吸附柱中,(吸附柱放入收集管中)13,000rpm 离心 2 分钟,弃掉废液。确保离心后液体全部滤过去,膜上没有残留,如有必要,可以加大离心力和离心时间。
6.加 700μl Solution PR3,室温放置 1 分钟,13,000rpm 离心 30 秒,弃掉废液。
7.加入 500μl Washing Buffer RW,13,000rpm 离心 30 秒,弃掉废液。重复一次。
8.将 RNase Free 吸附柱放回空收集管中,13,000rpm 离心 2 分钟,尽量除去漂洗液。
9.取出 RNase Free 吸附柱,放入一个 RNase Free 离心管中,在吸附膜的中间部位加 30-50μlRNase Free H2O(事先 70-90℃预热可提高产量),室温放置 1 分钟,12,000rpm 离心 1 分钟。
10.要提高 RNA 产量,可再加 30-50μl RNase Free H2O 重复步骤 9,合并两次洗液,或者将第一次的洗脱液加回到吸附柱重复洗脱一遍。洗脱两遍的 RNA 浓度高,分两次洗脱合并 RNA产量比前者高 15–30%,但是浓度要低,用户可根据需要选择。





